| ** | Latin American Journal of Clinical Sciences and Medical Technology is an open access magazine. To read all published articles and materials you just need to register Registration is free of charge. Register now If you already have registered please Log In | ** |
aServicio de Clínica del Dolor, Instituto Nacional de Cancerología, Ciudad de México, México.
Autor para correspondencia: , . Números telefónicos: ; e-mail: planky@incan.edu.mx
Lat Am J Clin Sci Med Technol. 2022 Feb;4:15-27.
Recibido: 05 de octubre, 2021
Aceptado: 20 de enero, 2022
Publicado: 03 de febrero, 2022
Vistas: 1887
Descargas: 23
En la Oncoguía del manejo del dolor en cáncer 2020 presentamos la epidemiología y dimensión del problema constituido por el dolor oncológico, la escalera analgésica de la Organización Mundial de la Salud —y sus progresivas adaptaciones—, la evaluación del dolor de origen oncológico (derivado de la enfermedad o asociado con el tratamiento oncológico y que debe incluir la historia clínica y exploración física completas), así como el uso de estudios de extensión. Igualmente, se aborda el manejo farmacológico basado en una evaluación multidimensional detallada de la severidad del dolor, que inicia en el nivel apropiado de la escalera para el grado de dolor y coincide con la farmacocinética del medicamento elegido. Se incluye también el uso de opioides, coadyuvantes, inhibidores de la recaptura de serotonina y noradrenalina, anticonvulsivantes y antagonistas NMDA (N-Methyl D-Aspartate). Asimismo, presentamos los lineamientos generales y objetivos para el manejo del dolor agudo, así como las fases de la atención y los principales manejos intervencionistas.
In Oncoguía del manejo del dolor en cáncer 2020 we present the epidemiology and the pathology scope caused by cancer pain, the World Health Organization’s analgesic ladder —and its subsequent adaptations—, the evaluation of the cancer-origin pain (that may be the result of the disease or be associated with the oncology treatment and that should include the complete clinical record and physical examination), and the use of the extension studies. Likewise, we addressed the pharmacological management based on the detailed multidimensional assessment of the pain severity, which starts at the appropriate level of the ladder for the pain degree and corresponds to the pharmacokinetics of the chosen drug. The use of opioids, coadjuvants, serotonin and noradrenaline uptake inhibitors, anticonvulsants, and N-Methyl D-Aspartate antagonists are also included. In the same way, we present the general guidelines and objectives for acute pain management and the medicare phases, as well as the primary interventionists management.
Estas guías son sugerencias y recomendaciones para el manejo de pacientes en condiciones ideales; no constituyen razonamientos costo-eficientes, ni determinantes para la compra de medicamentos. Su objetivo es proporcionar al lector las bases del manejo del dolor oncológico con base en la evidencia publicada y en la experiencia del Instituto Nacional de Cancerología (INCan).
El oncólogo, el algologo y el paliativista se enfrentan a diario con el dolor por cáncer, el cual a menudo se diagnostica y se trata inadecuadamente. Representa el tercer síntoma más frecuente entre el 65 y 85% de los pacientes, por lo que es el principal síntoma a tratar. Diferentes estudios han mostrado que entre 56 y 82.3% de las personas con dolor oncológico pueden estar siendo tratadas incorrectamente. En consecuencia, es crucial que los oncólogos, paliativistas y otros especialistas evalúen de manera regular y sistemática la presencia de dolor e indiquen un tratamiento temprano y adecuado para reducir el riesgo de sensibilización central y la cronificación del dolor.1
Epidemiología del dolor por cáncer
Cada año se diagnostican aproximadamente nueve millones de personas con cáncer. La Organización Mundial de la Salud (OMS) estima que el número de casos nuevos pasará de 10 a 30 millones en menos de 20 años (de 2000 a 2020).
La prevalencia del dolor incrementa con la progresión de la enfermedad oncológica, mientras que la intensidad, tipo y localización varía de acuerdo con el sitio primario del tumor, extensión, progresión de la patología y del tratamiento empleado. Según el reporte de la OMS, la incidencia de cáncer está en aumento y en 2020 habrá más de 15 millones de enfermos con cáncer. De acuerdo con la OMS, en 2012 se diagnosticaron 148,000 nuevos casos de cáncer en México; y los más frecuentes fueron el de mama y próstata, seguidos por cervicouterino, pulmonar, colon y recto.
Algunos estudios basados en la progresión de la tumoración reportan que en una población de 772 pacientes con cáncer avanzado, el dolor se presenta en el 28, 46, 67, 75 y 79%, a los 6 meses, 3 meses, 1 mes, 1 semana y 1 día antes de la muerte de los pacientes. Von Roenn realizó un estudio con 1,308 pacientes oncológicos ambulatorios, de los cuales 67% reportó dolor de forma reciente y, de ellos, 36% refirió dolor severo incapacitante. Larue reportó que 69% de los pacientes de la tercera edad con cáncer en etapa paliativa sufría dolor intenso incapacitante.2
Existen cientos de artículos disponibles acerca de la prevalencia del dolor en el paciente oncológico. El recientemente publicado por van den Beuken-van Everdingen, luego de una revisión sistémica de 40 años, es el más representativo porque reporta que más de un tercio de los enfermos calificó su dolor de moderado a intenso, y que la prevalencia combinada de dolor fue mayor al 50% en todos los tipos de cáncer, con la más alta prevalencia en pacientes con tumor de cabeza y cuello.3,4
Escalera analgésica de la OMS
En 1986, la OMS propuso un modelo reduccionista del abordaje del dolor por cáncer, la llamada Escalera Analgésica de la OMS (Figura 1).

Estos tres pasos consecutivos ayudan a legitimar el uso terapéutico de los opioides5 de la siguiente manera:
- En el primer escalón, el empleo de los analgésicos no opioides (paracetamol y AINE) por períodos cortos en caso de no estar contraindicados para el tratamiento del dolor leve;
- Avance hacia el escalón de los opioides leves (como codeína o hidrocodona) y
- Los opioides fuertes (como morfina y oxicodona) en caso de dolor de moderado a intenso (segundo y tercer escalón).
Sin embargo, este modelo no se adapta a todos los tipos de dolor como el agudo o el posoperatorio, para los cuales existen guías y algoritmos específicos.6
En 2002, España propuso el «ascensor analgésico», en el cual se inicia el tratamiento de forma inmediata con el medicamento propuesto en el escalón que corresponde de acuerdo con la intensidad del dolor.
En 2011 la National Comprehensive Cancer Network (NCCN) simplificó aún más el modelo de tratamiento, tras proponer sólo dos pasos (Tabla 1)7:
- En el dolor leve se utilizan no opioides y
- En el moderado a intenso se utilizan los opioides.
| Tabla 1. Comparativo entre la escalera analgésica de la OMS y las Guías NCCN | |
|---|---|
| Dolor 4-10: moderado a intenso | Opioide |
| Dolor 1-3: leve | No opioide |
| La tabla es original de los autores | |
Con base en la experiencia de nuestro grupo de la Clínica del Dolor, y en la de otros grupos, se han propuesto dos escalones más en la escalera analgésica, que incluyen el manejo intervencionista del dolor (Gráfica 1).8
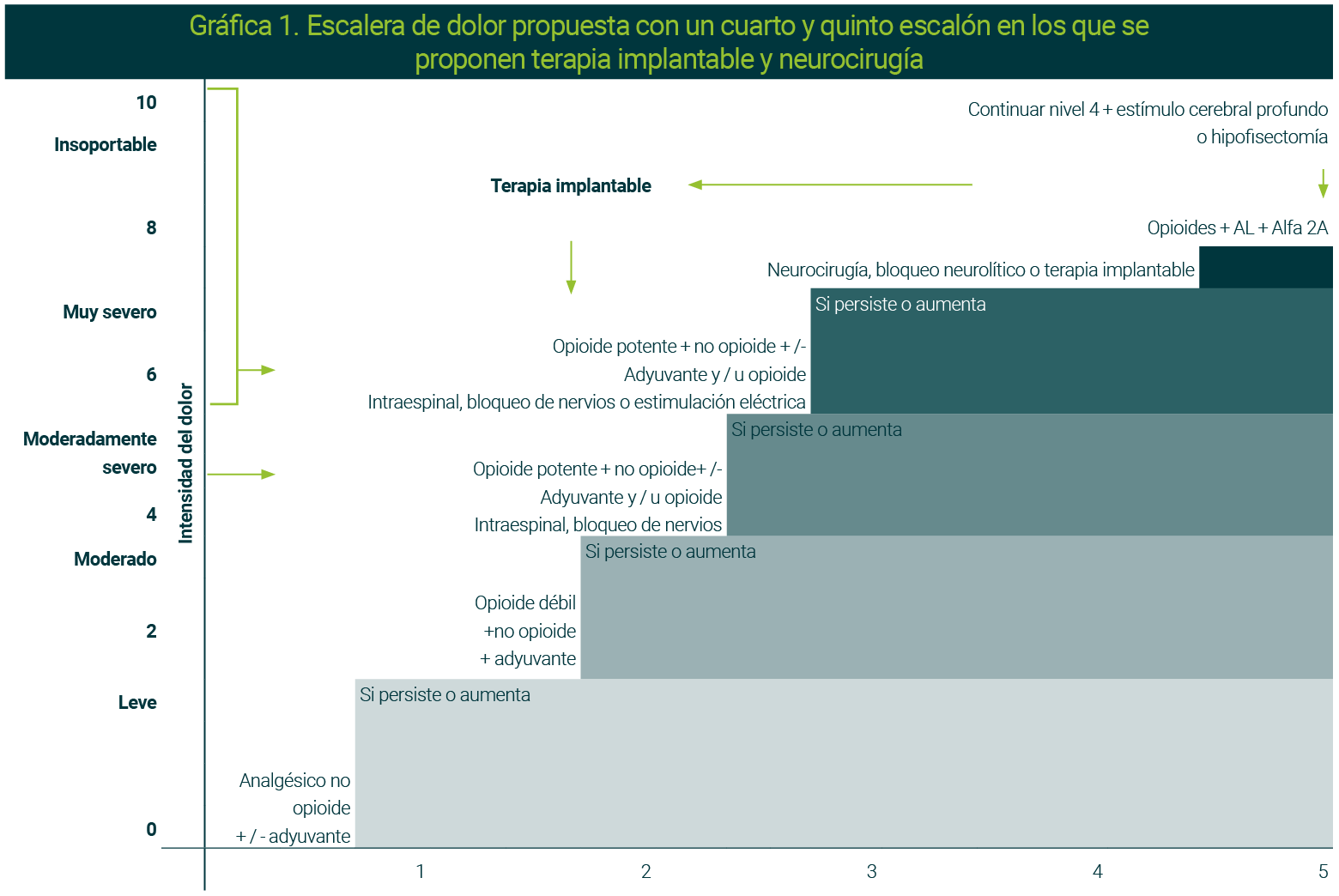
El dolor por cáncer es complejo y para poder valorarlo de manera adecuada es importante reconocer que el de origen oncológico puede derivarse de la enfermedad, estar asociado a ella o al tratamiento oncológico. Por lo tanto, es fundamental realizar una evaluación minuciosa y brindar un tratamiento adecuado para lograr un buen control del dolor.9,10
La evaluación del dolor oncológico debe incluir la historia clínica y exploración física completas, así como el uso de estudios de extensión (estudios de laboratorio e imagen).
Los rasgos más relevantes a evaluar son la intensidad, temporalidad, factores que alivian o empeoran, localización, efecto en la calidad de vida, características específicas del síntoma, su significado, actitudes de afrontamiento y experiencias dolorosas previas.11
Entre las características particulares en la evaluación del dolor está la medición de la intensidad del mismo. Para tal fin existen escalas unidimensionales y multidimensionales. Ejemplos de las herramientas unidimensionales son la escala numérica de 11 puntos (ENA) (Figura 2), que valora del 0 al 10 y es la más común, así como la escala verbal análoga (EVA) que divide el dolor en ausente, leve, moderado, severo e insoportable.

También existen herramientas de valoración más completas como la Brief Pain Inventory (BPI) y el cuestionario de McGill, los cuales son multidimensionales.12
Igualmente, es importante señalar que se deben considerar factores que pueden disminuir o incrementar la tolerancia al dolor en el paciente oncológico dado que ello influirá en la respuesta al tratamiento (Figura 3).
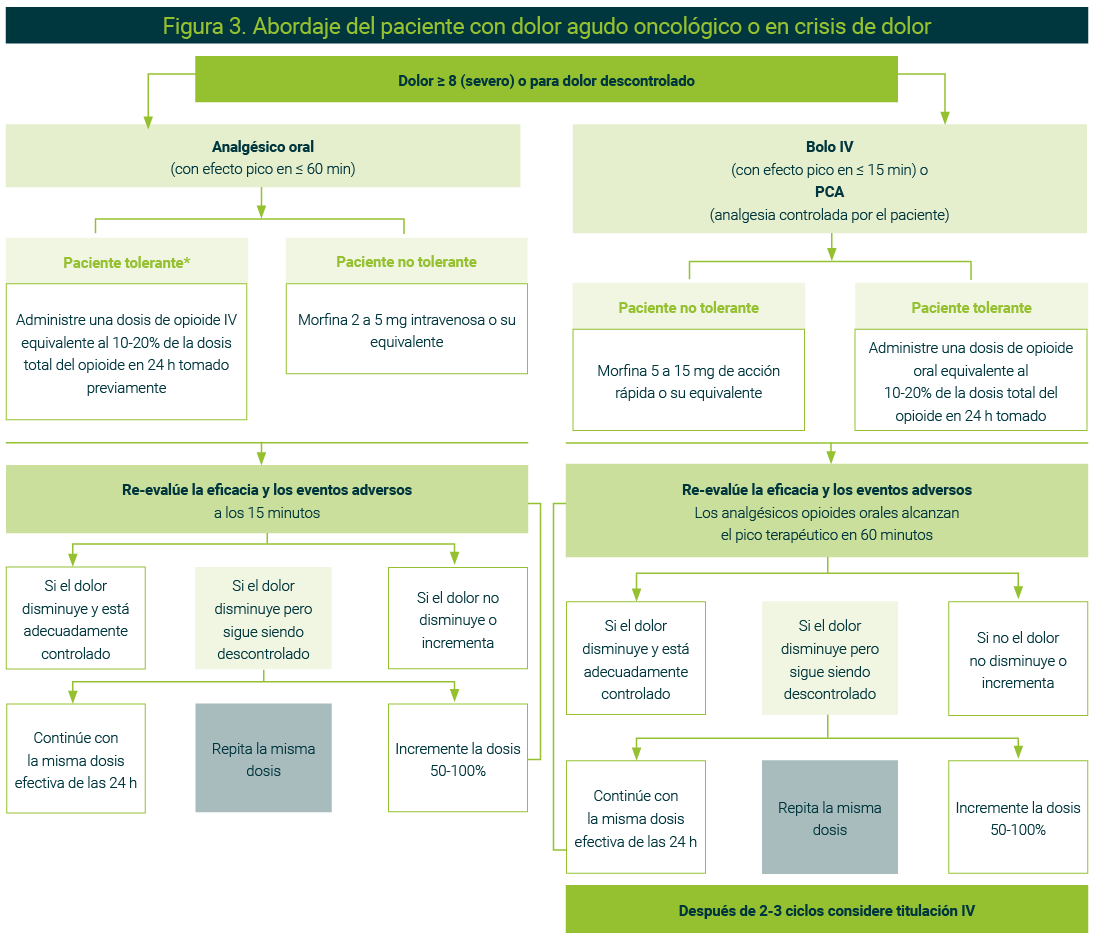
La figura es original de los autores
En cuanto a la temporalidad, el dolor se divide en agudo y crónico. Se considera que es crónico después de tres meses de evolución de forma constante.
En el dolor oncológico es importante valorar los cambios durante el día, particularmente la presencia de dolor irruptivo, que se define como un dolor súbito, transitorio, de intensidad moderada a severa con una duración menor de 30 minutos y una frecuencia de máximo cuatro episodios al día. Éste se puede medir mediante herramientas como el cuestionario Alberta Breakthrough Pain Assesment Tool, el cual está diseñado para valorar este tipo de dolor y recientemente ha sido validado al español.11,13
Las características del dolor nos ayudan a identificar los mecanismos fisiopatológicos y a elegir las medidas terapéuticas que se utilizarán para el alivio del mismo.
Específicamente para el dolor de origen neuropático existen diferentes escalas de evaluación, entre las que se encuentran Pain DETECT, LANSS, Doleur Neuropathic-4 (DN-4).12,13
El manejo del dolor en cáncer se basa en un tratamiento multidisciplinario en el que la escalera analgésica de la OMS forma parte del mismo. Existen lineamientos generales propuestos por la OMS para la prescripción farmacológica en este grupo de enfermos con dolor tálámico.9
Principios del Programa de Alivio del Dolor por Cáncer:
- Evaluación multidimensional detallada de la severidad del dolor.
- Iniciar en el nivel apropiado de la escalera para el grado de dolor, basado en los resultados de la evaluación.
- Dar analgesia con base en la farmacocinética del medicamento elegido y su formulación.
- La medicación para el dolor deberá ser prescrita contra horario.
- Los laxantes deberán ser indicados en la mayoría de los pacientes con opioides.
Sea un opioide o un neuromodulador, los fármacos deben titularse para obtener el bienestar máximo.14 En caso de indicarse reducción de opioide, se deberá disminuir del 25 a 50% en 24 horas, a fin de prevenir la supresión de opioides o crisis de dolor. Se deberá evitar el uso de antagonistas (nalbufina y naloxona).14
Es importante considerar e individualizar el equilibrio entre la analgesia y la disminución del estado de conciencia, así como también individualizar las vías de administración, conforme los factores de recomendación establecidos (Tabla 2). En caso de dolor óseo, considerar la radioterapia paliativa.14
| Tabla 2. Vías de administración y farmacodinamia de morfina | |||
|---|---|---|---|
| Vía de administración | Biodisponibilidad | Inicio de acción | Duración de acción |
| Oral | 35-45% | 20-30 min | 4-5 h |
| Intravenosa | 100% | 10-15 min | 2 h |
| Subcutánea | 50% | 15 min | 4 h |
| La tabla es original de los autores | |||
Opioides
Estos analgésicos ejercen su efecto al unirse a los receptores opioides, particularmente a los más conocidos (mu, delta y kappa). Todos los receptores son proteínas G, distribuidas extensamente en el sistema nervioso central y, en menor medida, en la periferia. Cuando un opioide se une a su receptor, se genera una hiperpolarización celular y disminución de la descarga de neurotransmisores. Se cree que la principal acción es el estímulo de vías inhibitorias descendentes que modulan la transmisión nociceptiva de la periferia al tálamo.9,15 Los opioides se clasifican por su potencia de acción (débiles y potentes) o por su mecanismo de acción (agonistas puros, parciales, antagonistas y antagonistas puros).
El estándar de oro con relación a los opioides en dolor por cáncer es la morfina, ya que es el fármaco de referencia tanto para identificar la potencia de otros opioides en su prescripción como para su rotación.16 En la Figura 4 se presenta el algoritmo de manejo farmacológico del paciente con dolor por cáncer, que considera si se le ha prescrito o no un opioide previamente.
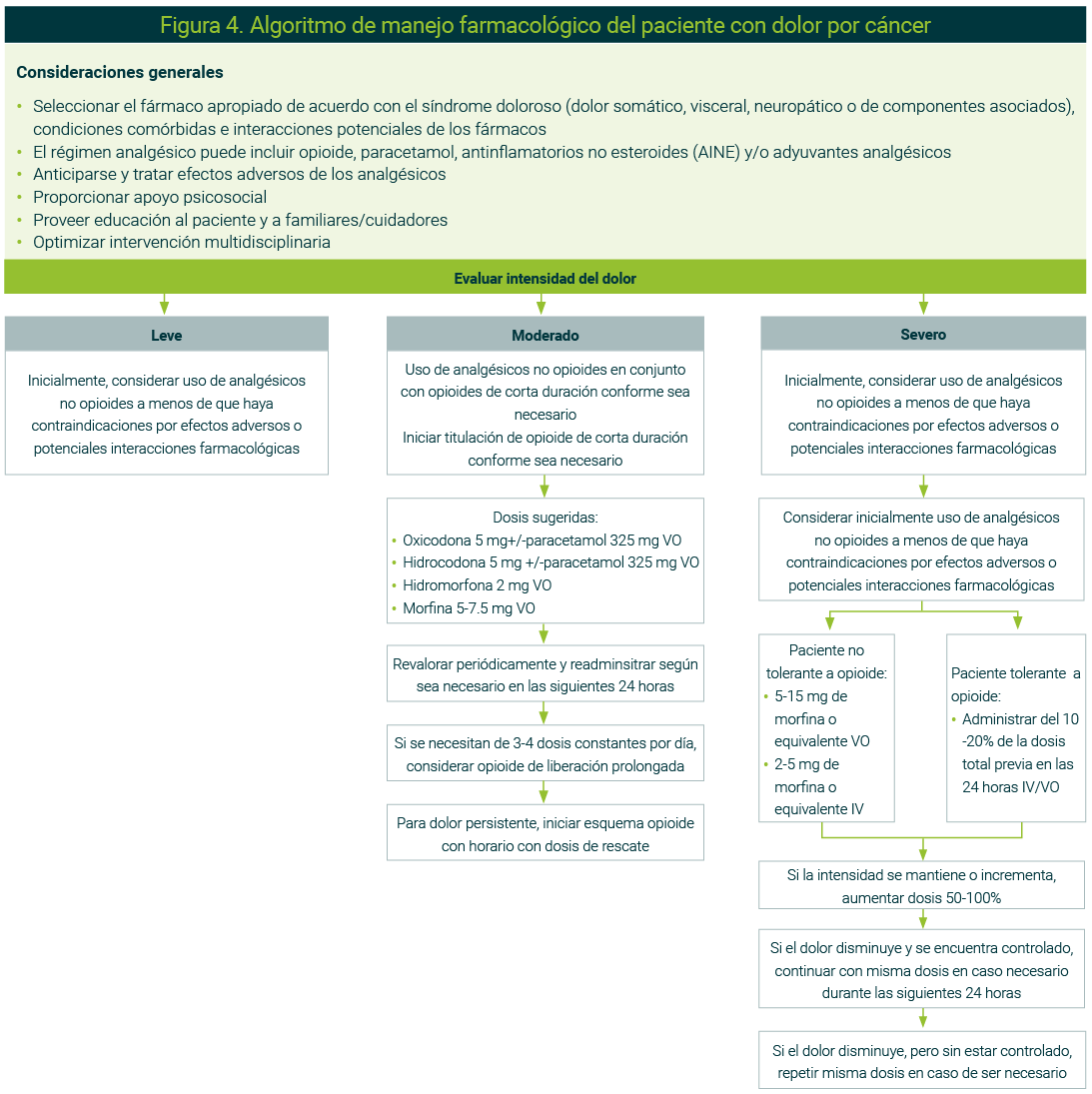
La figura es original de los autores
Los pacientes con cáncer pueden requerir cambios en la terapia opioide debido a la progresión de la enfermedad, modificación en las características del dolor, uso prolongado de opioides o presencia de lesión renal o hepática.17,18 El objetivo de la rotación es obtener una cantidad de opioide equivalente a la dosis utilizada previamente. Al calcular la dosis del nuevo opioide se debe iniciar con la dosis mínima efectiva; el factor de conversión con metadona aumenta al utilizar dosis mayores.
Coadyuvantes
Son medicamentos cuya indicación primaria no es el tratamiento para el dolor, pero poseen ese efecto analgésico bajo ciertas circunstancias. Se pueden prescribir en dolor mixto por cáncer (somático y neuropático), dolor neuropático (DN) oncológico, incluida la neuropatía inducida por quimioterapia y dolor óseo metastásico.19
Los agentes no opioides frecuentemente utilizados son antidepresivos, anticonvulsivos, ansiolíticos, neurolépticos, esteroides y bifosfonatos. Describiremos algunos en la Tabla 3.20
| Tabla 3. Coadyuvantes | ||||
|---|---|---|---|---|
| Clase | Fármaco | Farmacocinética | Metabolismo | Eliminación |
| Antidepresivos | Amitriptilina | Se requieren de 2 a 3 semanas de tratamiento para iniciar su acción antidepresiva | Amplio metabolismo hepático por medio del citocromo P450 (CYP1A2, CYP2C, CYP3A4) | Predominantemente renal, alrededor de 80% de forma inactiva |
| Inhibidores de la recaptura de serotonina y noradrenalina | Duloxetina | Se absorbe bien por vía oral y alcanza concentraciones máximas a las 6 h. La biodisponibilidad es de 32% a 80% (media de 50%), y la distribución del 96% | Su metabolismo es dependiente de la enzima CYP1A2, CYP2D6 y, posteriormente, sometida a un metabolismo de conjugación | En pacientes con enfermedad renal en fase terminal, los valores de concentración máxima y área baja la curva son elevados. En insuficiencia hepática moderada (Child Pugh clase B), concentración plasmática 2.3 veces mayor |
| Anticonvulsivantes | Gabapentina | La absorción ocurre en el intestino delgado | Su metabolismo hepático es mínimo | Se elimina vía renal, se excreta por la orina tanto por filtración glomerular como por secreción tubular activa. Su aclaramiento renal es de 125 ml/min |
| Pregabalina | Su absorción es dosis dependiente. Su biodisponibilidad es de 90% e independiente de la dosis y frecuencia de administración | |||
| Antagonistas NMDA | Ketamina | Su metabolismo hepático es mínimo | Se excreta renalmente. Presenta cierta reabsorción tubular. Su aclaramiento renal es de 70 ml/min | |
| La tabla es original de los autores | ||||
Antidepresivos tricíclicos
Inhiben la recaptura de monoaminas (serotonina y noradrenalina) desde la terminal presináptica mediante la activación de los sistemas descendentes inhibitorios del dolor; también producen bloqueo de canales (colinérgicos, adrenérgicos, histaminérgicos y canales iónicos como el de sodio). Su efecto analgésico es independiente de su efecto antidepresivo.21
Por años, la amitriptilina ha sido considerada uno de los tratamientos de primera línea para el dolor neuropático. Sin embargo, en una revisión de Cochrane no se encontró buena evidencia, por lo que podría existir una sobrevaloración de su efecto. Los autores concluyeron que amitriptilina debe continuar utilizándose como parte del tratamiento del dolor neuropático, pero entendiendo que en sólo una minoría de personas se logrará control satisfactorio del dolor.22-24
Inhibidores de la recaptura de serotonina y noradrenalina
La duloxetina, inhibidor de la recaptura de serotonina (5-HT) y de noradrenalina (NA), inhibe débilmente la recaptación de dopamina.25
Anticonvulsivantes
Los gabapentinoides actúan como inhibidor de la subunidad alfa-2-delta de los canales de calcio dependiente de voltaje, al impedir el ingreso excesivo de calcio, que controla la liberación de neurotransmisores en neuronas sensoriales periféricas, y disminuir la liberación de neurotransmisores (glutamato, monoaminas, sustancia P y péptido relacionado con el gen de calcitonina) involucrados en el dolor (Tabla 4).26,27
| Tabla 4. Dosis terapéutica y contraindicaciones de los coadyuvantes en el tratamiento del DN | ||
|---|---|---|
| Fármaco | Rango terapéutico Dolor crónico neuropático | Precauciones |
| Amitriptilina | 25-50 mg, dosis máxima 150 mg | Enfermedad cardica, glaucoma |
| Duloxetina | 60-120mg | En adultos mayores, vida media 25% más prolongada Enfermedad hepática |
| Gabapentina | 900 hasta 3600 mg Se recomienda administrar en un intervalo de cada 8 horas | Antiácidos con sales de aluminio o magnesio disminuyen su biodisponibilidad Dosis máximas recomendadas: CI cr 30-59 mL/min: 700 mg dos veces al día CI cr 15-29 mL/min 700 mg 1 vez al día < 15 mL/min 300 mg 1 vez al día Dosis suplementaria en hemodiálisis: 100 a 300 mg posterior a diálisis |
| Pregabalina | 150 hasta 600 mg Administrada cada 8 o 12 horas | Dosis máximas recomendadas: CI cr 30-59 mL/min: 150 mg dos veces al día (BID) 100 mg tres veces al día (TID) CI cr 15-29 mL/min: 15 mg BID; 50 mg TID < 15 mL/min 75mg 1 vez al día; algunos autores no recomiendan su uso Dosis suplementaria en hemodiálisis: 75 a 100 mg posterior a diálisis |
| La tabla es original de los autores | ||
Antagonistas NMDA
Forma parte del armamentario para tratamiento del dolor neuropático de difícil control, asociado a cáncer. Sin embargo, no se cuenta con suficiente evidencia para extender una recomendación debido a que sólo se dispone de estudios de baja calidad.28 La dosis terapéutica de ketamina intravenosa se establece en un rango de 0.25 mg/kg hasta 1 mg/kg, con un efecto hasta por tres horas.29
Además de un tratamiento farmacológico, se deberán considerar esquemas no farmacológicos que disminuyan y optimicen el control del dolor en los pacientes oncológicos (Figura 5).
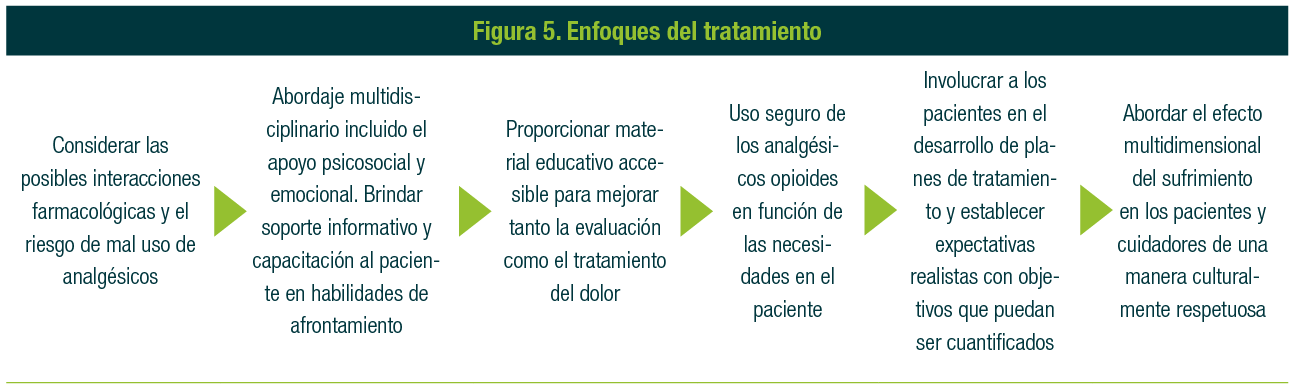
Dado que el dolor es uno de los síntomas más temidos en la población oncológica, su manejo debe ser estandarizado y estratificado.
Dentro de las intervenciones terapéuticas existen lineamientos generales que son tipificados como las «5 As» (por su nomenclatura en inglés) de los objetivos esperados (Tabla 5). La re-evaluación del paciente con dolor deberá fijarse en un calendario para asegurarse de que la terapia analgésica brinde un máximo beneficio con un perfil mínimo de eventos adversos y que el tratamiento indicado es el que está siguiendo el paciente.
| Tabla 5. Las «5 A» de los objetivos en el tratamiento del dolor en el paciente con cáncer |
|---|
| 1. Analgesia (optimizar analgesia) |
| 2. Actividades (optimizar las actividades de la vida diaria) |
| 3. Eventos Adversos (minimizar los eventos adversos) |
| 4. Consumo de drogas Aberrantes (evitar el consumo de drogas aberrantes) |
| 5. Afecto (considerar relación del dolor y estado de ánimo) |
| La prevención de los efectos secundarios asociados a los analgésicos, especialmente el estreñimiento, es de suma importancia. Para el dolor agudo, severo o crisis de dolor, considere la atención hospitalaria o su admisión de ser necesario. Trate el dolor oncológico persistente con un esquema analgésico con dosis horaria o y/o de acción prolongada. En dolor irruptivo indique dosis de rescate con analgésicos opioides de acción corta. La tabla es original de los autores |
Cuando el paciente requiera atención por una crisis de dolor, se deben aplicar las recomendaciones de las Guías de NCCN 2019 (Tabla 6).
| Tabla 6. Fases de la atención | |
|---|---|
Instruya | Al paciente acerca de la importancia de seguir el plan de tratamiento del dolor; programar y mantener sus citas ambulatorias; contactar al médico o atenderse en forma inmediata o en urgencias si el dolor empeora o los eventos adversos sobrepasan la ventana terapéutica o son catalogados como severos (incluida la atención fuera del horario laboral matutino para facilitar la titulación del analgésico opioide). |
Evalúe |
|
Comunique |
|
| La tabla es original de los autores | |
Las guías NCCN 2019 para el manejo de dolor oncológico recomiendan considerar estrategias intervencionistas cuando el alivio del dolor se pueda obtener con el bloqueo de una estructura nerviosa, exista falla para lograr una analgesia adecuada a pesar de un esquema farmacológico óptimo o existan efectos adversos intolerables (Tabla 7).
| Tabla 7. Manejo intervencionista del dolor | |
|---|---|
| Bloqueos somáticos más frecuentes | Bloqueos en territorios simpáticos más frecuentes |
| Ganglio esfenopalatino | Esfenopalatino |
| Bloqueo TAP (plano del transverso abdominal) | Ganglio estrellado |
| Bloqueo de los nervios intercostales | Cadena simpática torácica T2 y T3 |
| Bloqueo paravertebral | Inhibición de nervios esplácnicos |
| Bloqueos de la musculatura lumbar y glútea | Inhibición de plexo celíaco |
| Cuadrado lumbar | Bloqueo simpático lumbar |
| Psoas lumbar | Inhibición del plexo hipogástrico superior |
| Músculo piriforme | Ganglio impar o de Walther |
| Bloqueo del plano del músculo erector de la espina | |
| Bloqueo PENG (grupo nervioso pericapsular) | |
| La tabla es original de los autores | |
El manejo intervencionista consiste en procedimientos especiales para el manejo y tratamiento del dolor. Aunque es una herramienta útil en el paciente con cáncer en cualquier etapa de la enfermedad, no es un último recurso, ya que se ha identificado la necesidad de aplicar estas técnicas desde el abordaje inicial como método diagnóstico, pronóstico, profiláctico o bien terapéutico (Figura 6 y Tabla 8).

| Tabla 8. Clasificación de los procedimientos intervencionistas en dolor | ||
|---|---|---|
| Función | Definitivos | Identifican el origen del dolor |
| Pronóstico | Permiten conocer el grado de analgesia que se obtendrá con un procedimiento, así como los efectos secundarios de éste | |
| Profiláctico | Se realizan antes de un estímulo doloroso (por ejemplo; previo a una amputación) | |
| Terapéutico | Su finalidad es disminuir o eliminar el dolor | |
| Duración | Temporales | Se realizan con anestésico local y esteroide |
| Definitivos | Se realizan con agentes neurolíticos o con dispositivos implantables como las bombas intratecales y los neuroestimuladores de cordones posteriores | |
| Territorio | Somático | |
| Simpático | ||
| La tabla es original de los autores | ||
Por lo tanto, los pacientes se pueden beneficiar desde etapas tempranas de la enfermedad oncológica, con enfermedad activa, supervivientes al cáncer, pacientes en etapa terminal e incluso los pacientes oncológicos con dolor no oncológico (lumbalgia, migraña, artralgias, etc.).
El intervencionismo representa, por lo tanto, una parte importante del manejo multimodal del dolor para un problema de origen multifactorial. Se debe considerar que la mejor terapia es la que sea más sencilla, tenga menor riesgo y esté asociada a una probabilidad aceptable de lograr resultados deseados.
Las opciones van desde la administración de esteroides, anestésicos locales, aplicación de radiofrecuencia (pulsada o continua), crioterapia, sustancias neurolíticas (alcohol, fenol o glicerol en diferentes concentraciones) hasta terapias implantables (bomba intratecal y neuroestimulador de cordones posteriores). Con el avance de la tecnología se han desarrollado técnicas más seguras y efectivas, con menos efectos secundarios (Fotografías 1 y 2).
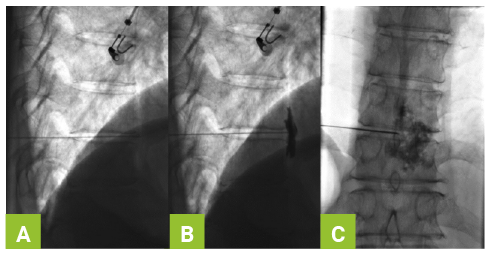
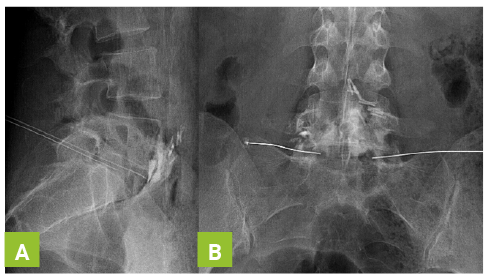
Algunas razones por las cuales un paciente puede ser candidato a intervencionismo son:
- Alivio inadecuado del dolor con terapia convencional
- Dolor mediado por el simpático
- Efectos colaterales excesivos de los fármacos
- Imposibilidad de medicación oral o transdérmicos
- Limitaciones en la disponibilidad de los analgésicos
- Dificultad para el manejo domiciliario
- Rechazo del paciente al programa farmacológico
Para indicar estos procedimientos se debe realizar una evaluación correcta del origen del dolor, características, ubicación, intensidad, factores que modifican y los aspectos psicosociales, económicos y familiares del dolor.
No todos los pacientes son candidatos por lo que no sólo se deberán considerar todos los aspectos del paciente (físico, económico, social y psicológico)31,32 sino que se debe valorar el factor riesgo-beneficio, considerando diferentes aspectos (Tabla 9).33
| Tabla 9. Aspectos a evaluar antes del manejo intervencionista del dolor | |
|---|---|
| Físico |
|
| Económico y social |
|
| Psicológico |
|
| La tabla es original de los autores | |
Osteocementoplastías
Las metástasis óseas representan la causa más común de dolor relacionado con cáncer. El 65% de los pacientes con cáncer de próstata o mama presenta dolor esquelético o relacionado con metástasis óseas. Los huesos representan el tercer sitio de enfermedad metastásica, después de hígado y pulmón.
En caso de que el enfermo presente metástasis óseas complicadas (como compresión de la médula espinal o riesgo de fractura), la terapia analgésica consistirá en radioterapia o cirugía. La radioterapia paliativa es la forma empleada con mayor frecuencia y se prescribe con el objetivo de reducir la intensidad del dolor, disminuir o eliminar el uso de analgésicos, posibilitar una mejoría funcional y reducir el riesgo de fracturas en el esqueleto axial.30,34
La vertebroplastía percutánea es, sin duda, una opción eficaz que consiste en la inyección de polimetilmetacrilato a la vértebra fracturada con el objetivo de fortalecerla y disminuir el dolor agudo, con lo cual además se logra la estabilización de la fractura (Fotografía 3 y Tabla 10). La femoroplastía consiste en la inyección del polimetilmetacrilato en el cuello del fémur.30,35
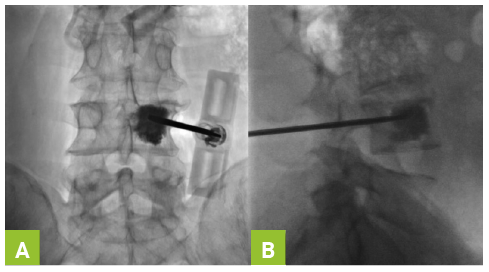
| Tabla 10. Indicaciones de vertebroplastía |
|---|
|
| La tabla es original de los autores |
Bombas implantables
La Food and Drug Administration (FDA) aprobó la infusión espinal de fármacos desde 1991. Está indicada en pacientes que no han respondido al tratamiento convencional o que presentan efectos secundarios indeseables.
En consecuencia, los pacientes con dolor nociceptivo, dolor neuropático severo y espasticidad36 se pueden beneficiar de la infusión espinal de fármacos como morfina (que por esta vía brinda mayor potencia con menor perfil de eventos adversos), baclofeno o ziconotida, independientemente de su origen oncológico o no oncológico.
Cabe mencionar que son los médicos entrenados quines deben seleccionar y llevar a cabo este tipo de abordajes porque debe realizarse una vigilancia estrecha y se deben proporcionar las condiciones adecuadas para disminuir los riesgos asociados a estas técnicas y lograr una adecuada ventana analgésica.14
El dolor es uno de los síntomas más comunes en el cáncer. Es muy complejo porque tiene diferentes etiologías y mecanismos fisiopatológicos. Por ende, realizar una adecuada evaluación es fundamental para conocer las características del dolor y otras comorbilidades, lo cual nos permitirá realizar un abordaje terapéutico adecuado.
Dentro de los tratamientos analgésicos existen diferentes posibilidades que incluyen fármacos, procedimientos intervencionistas y tratamientos no farmacológicos (manejo psicológico y rehabilitación física). Asimismo, debe equilibrarse el acceso a los opioides, vigilar su adecuada administración y garantizarse la disponibilidad del medicamento a la par de herramientas para restringir su mala utilización.
Es menester recalcar que el tratamiento farmacológico ha logrado un gran beneficio, y que el manejo intervencionista del dolor ha demostrado ser útil dentro del control analgésico. Además, el tratamiento no farmacológico es una condición necesaria e indispensable como coadyuvante en el manejo multimodal del dolor.
| 1. | World Health Organization. Cancer pain relief [Internet] 1986. [Retrieved on August 2023]. Available from URL: https://apps.who.int/iris/handle/10665/43944 |
| 2. | Reyes-Chiquete D, González Ortiz JC, Mohar Betancourt A, Meneses García A. Epidemiología del dolor por cáncer. Rev Soc Esp Dolor. 2011;18(2):118-34. |
| 3. | Portenoy RK, Miransky J, Thaler HT, Hornung J, Bianchi C, Cibas-Kong I, et al. Pain in ambulatory patients with lung or colon cancer. Prevalence, characteristics and effect. Cancer. 1992;70(6):1616-24. |
| 4. | van den Beuken-van Everdingen MH, Hochstenbach LMJ, Joosten EAJ, Tjan-heijnen VCG, Janssen DJA. Update on prevalence of pain in patients with cancer: Systematic review and meta-analysis. J Pain Symptom Manage. 2016;51(6):1070-1090.e9. |
| 5. | Torres LM. Calderón E, Pernia A, Martínez-Vázquez J, Micó JA. De la escalera al ascensor. Rev Soc Esp Dolor. 2002;9:289-90. |
| 6. | National Comprehensive Cancer Network. Clinical Practice Guidelines in Oncology. Adult Cancer Pain. [Retieved in August 2023] Available from URL: https://www.nccn.org/guidelines/guidelines-detail?category=3&id=1413 |
| 7. | World Health Organization. Cancer pain relief with a guide to opioid availability. 2nd ed. Geneva, 1996. [Retrieved in August 2023] Available from URL: https://apps.who.int/iris/handle/10665/37896 |
| 8. | Plancarte-Sánchez R, Mille-Loera JE, Mayer-Rivera FJ. Manejo del dolor en cáncer. Cir Ciruj. 2002;70:356-68. |
| 9. | Plancarte Sánchez R, Mayer Rivera FJ. Manual de alivio del dolor y cuidados paliativos en pacientes con cáncer. McGgraw-Hill Interamericana; 2003. 665 p. |
| 10. | Gutgsell T, Walsh D, Zhukovsky DS, Gonzales F, Lagman R. A prospective study of the pathophysiology and clinical characteristics of pain in a palliative medicine population. Am J Hosp Palliat Care. 2003;20(2):140-8. |
| 11. | Caraceni A, Shkodra M. Cancer pain assesment and classification. Cancer (Basel). 2019;11(4):510. |
| 12. | Sayal P, Johnson C, Kim PY. Comprehensive evaluation of paitients with cancer pain. In: Abd-Elsayed A (ed), Pain. A review guide. Switzerland: Springer Cham; 2019. p. 941-3. |
| 13. | Stewart J. The challenges of cancer pain assessment. Ulster Med J. 2004;83(1):44-6. |
| 14. | MASCC/ISOO. Annual Meeting on Supportive Care in Cancer. [Internet]; Vienna, Austria, 28-30 June. 2018 [Retrieved in August 2023]. Available from URL: https://www.frontiersin.org/events/MASCC_ISOO_Annual_Meeting_on_Supportive_Care_in_Cancer_2018_Vienna_Austria/5303/blog |
| 15. | Pathan H, Williams J. Basic opioid pharmacology: An update. Br J Pain. 2012;6(1):11-6. |
| 16. | Sverrisdóttir E, Meldgaard Lund T, Estrup Olesen A, Mohr Drewes A, Louring Christrup L, Kreilgaard M. A review of morphine and morphine-6-glucuronide’s pharmacokinetic-pharmacodynamic relationships in experimental and clinical pain. Eur J Pharm Sci. 2015; 74:45-62. |
| 17. | Trescot AM, Datta S, Lee M, Hansen H. Opioid pharmacology. Pain Physician. 2008; 11(2 Suppl):S133-53. |
| 18. | Dyer O. WHO retracts opioid guidelines after accepting that industry had an influence. BMJ. 2020; 368:m105. |
| 19. | van den Beuken-van Everdingen MHJ, de Graeff A, Jongen JLM, Dijkstra D, Mostovaya I, Vissers KC, et al. Pharmacological treatment of pain in cancer patients: The role of adjuvant analgesics, a systematic review. Pain Pract. 2017;17(3):409-19. |
| 20. | Vardy J, Agar M. Nonopioid drugs in the treatment of cancer pain. J Clin Oncol. 2014;32(16):1677-90. |
| 21. | Mimenza Alvarado A, Aguilar Navarro S. Actualidades en el tratamiento del dolor neuropático. Rev Mex Neuroci. 2010; 11(2):141-9. |
| 22. | Moore RA, Derry S, Aldington D, Cole P Wiffen PJ. Amitriptyline for neuropathic pain in adults. Cochrane Database Syst Rev. 2015; 2015(7)(7): CD008242. |
| 23. | Moore RA, Derry S, Aldington D, Cole P Wiffen PJ. Amitriptyline for neuropathic pain and fibromyalgia in adults. Cochrane Database Syst Rev. 2012;12: CD008242. |
| 24. | Raouf M. Atkinson TJ, Crumb MW, Fudin J. Rational dosing of gabapentin and pregabalin in chronic kidney disease. J Pain Res. 2017;10:275-8. |
| 25. | Lavoie Smith EM, Pang H, Cirrincione C, Fleishman S, Paskett ED, Ahles T, et al. Effect of duloxetine on pain, function, and quality of life among patients with chemotherapy-induced painful peripheral neuropathy: A randomized clinical trial. JAMA. 2013;309(13):1359-67. |
| 26. | Jara C, del Barco S, Grávalos C, Hoyos S, Hernández B, Muñoz M, et al . SEOM clinical guideline for treatment of cancer pain (2017). Clin Transl Oncol. 2018;20(1):97-107. |
| 27. | Calandre EP, Rico-Villademoros F, Slim M. Alpha2delta ligands, gabapentin, pregabalin and mirogabalin: A review of their clinical pharmacology and therapeutic use. Expert Rev Neurother. 2016;16(11):1263-77. |
| 28. | Bell RF, Eccleston C, Kalso EA. Ketamine as an adjuvant to opioids for cancer pain. Cochrane Database Syst Rev. 2012;11:CD003351. |
| 29. | Mercadante S, Arcuri E, Tirelli W, Casuccio A. Analgesic effect of intravenous ketamine in cancer patients on morphine therapy: A randomized, controlled, double-blind, crossover, double-dose study. J Pain Symptom Manage. 2000;(4):246-52. |
| 30. | Plancarte SR, Hernández-Porras BC. Bloqueo del axis celiaco en dolor por cáncer: medicina de oportunidad. Rev Soc Esp Dolor. 2019;26(5):317-9. |
| 31. | Plancarte-Sánchez R, Velázquez R, Patt RB. Cancer pain. Eur J Palliat Care. 1993;377-425. |
| 32. | Plancarte R, Guajardo-Rosas J, Reyes-Chiquete D, Chejne-Gómez F, Plancarte A, González-Buendía NI, et al. Management of chronic upper abdominal pain in cancer : Transdiscal blockade of the splanchnic nerves. Reg Anesth Pain Med. 2010; 35(6):500-6. |
| 33. | Plancarte-Sánchez R, Guajardo-Rosas J, Cerezo-Camacho O, Chejne-Gómez F, Gómez-García F, Meneses-García A, et al. Femoroplasty: A new option for femur metastasis. Pain Pract. 2013;13(5):409-15. |
| 34. | Allende Pérez S, Acosta Espinoza A, Aguilar León S, Alcorta Garza AG, Arzate Mireles CE, Ascencio Huertas L, et al. Consenso Mexicano de Dolor por Cáncer. Gac Mex Oncol. 2016;15(S1):3-34. |
| 35. | Raj PP, Lou L, Staats PS, Erdine S, Staats PS. Radiographic imaging for regional anesthesia and pain management. New York: Churchill Livingstone; 2003. |
| 36. | Christo PJ, Mazloomdoost D. Cancer pain and analgesia. Ann NY Acad Sci. 2008; 1138:278-98. |
All Rights Reserved® 2019
Latin American Journal of Clinical Sciences and Medical Technology,Publicación contínua • Editor responsable: Gilberto Castañeda Hernández. • Reserva de Derechos al Uso Exclusivo: 04-2019-062013242000-203; ISSN: 2683-2291; ambos otorgados por el Instituto Nacional del Derecho de Autor. • Responsable de la última actualización de este número, Web Master Hunahpú Velázquez Martínez,
Calle Profesor Miguel Serrano #8, Col. Del Valle, Alcaldía Benito Juárez, CP 03100, Ciudad de México, México. Número telefónico: 55 5405 1396 • Fecha de última modificación, 28 de agosto de 2024.
All Rights Reserved® 2019
Publicación contínua • Editor responsable: Gilberto Castañeda Hernández. • Reserva de Derechos al Uso Exclusivo: 04-2019-062013242000-203; ISSN: 2683-2291; ambos otorgados por el Instituto Nacional del Derecho de Autor. • Responsable de la última actualización de este número, Web Master Hunahpú Velázquez Martínez,
Calle Profesor Miguel Serrano #8, Col. Del Valle, Alcaldía Benito Juárez, CP 03100, Ciudad de México, México. Número telefónico: 55 5405 1396 • Fecha de última modificación, 28 de agosto de 2024.